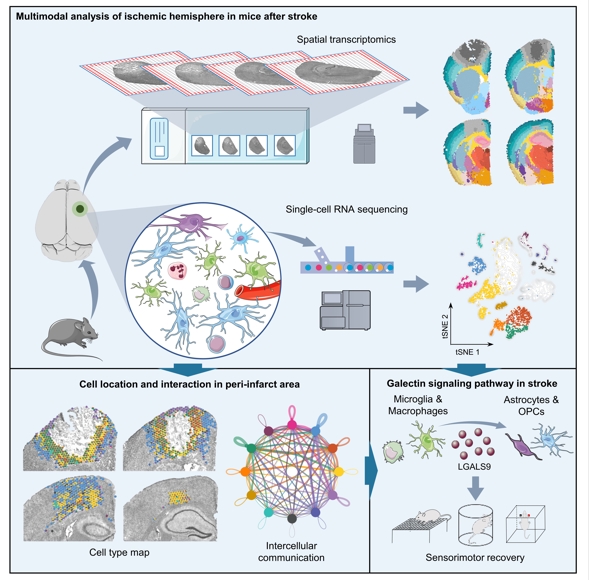
2024年2月7日,1929cc威尼斯、江苏省重症医学重点实验室姚红红教授团队与南京航空航天大学姜伟教授团队合作在国际权威学术期刊Science Translational Medicine刊发了题为“Integrating spatial and single-cell transcriptomics to characterize the molecular and cellular architecture of the ischemic mouse brain”的研究论文。该论文使用单细胞测序与空间转录组测序技术并进行整合分析,对缺血性卒中模型小鼠大脑的基因表达和细胞互作特征进行了深入解析。

脑卒中是一种具有高发病率、高致残率、高死亡率和高复发率等特点的急性脑血管疾病。其中,缺血性卒中的发病率约占全部卒中的80%左右。血管再通是缺血性卒中的有效治疗方法,但因其严格的治疗时间窗限制,仅有少数患者受益。幸存患者长期存在肢体感觉运动、情感认知等障碍,因此,如何有效促进卒中后脑修复是亟待解决的科学问题。
神经炎症在卒中病理进程中扮演重要的角色,并发挥“双刃剑”的作用。目前,对于缺血大脑,尤其是梗死周围区的神经炎症特征了解并不全面。研究团队首先对缺血性卒中模型小鼠大脑进行空间转录组分析,识别梗死周围区特异性基因集群。进一步对梗死周围区进行单细胞测序,并与空间转录组进行整合分析,明确了异质性细胞的空间和互作特征。此外,研究团队发现,GALECTIN信号通路在卒中后显著增强。并且,GALECTIN信号通路中的重要配体Lgals9主要由小胶质细胞和巨噬细胞分泌,并作用于表达Cd44的星形胶质细胞和少突胶质细胞前体细胞。通过构建脑靶向的细胞外囊泡并将Lgals9递送至脑部,可以有效促进卒中模型小鼠的脑修复。本研究不但建立了缺血性卒中模型小鼠大脑的空间和单细胞转录图谱,并发现Lgals9-Cd44通路在促进卒中后脑修复中的重要作用,为卒中有效治疗手段的开发提供了新的靶点。
该论文第一作者为1929cc威尼斯韩冰副教授和南京航空航天大学周顺衡博士,南京航空航天大学姜伟教授和1929cc威尼斯姚红红教授为该论文共同通讯作者。该研究得到国家自然科学基金杰出青年科学基金、国家自然科学基金重点项目以及科技部科技创新2030—“脑科学与类脑研究”重大项目等资助。
论文链接:https://www.science.org/doi/10.1126/scitranslmed.adg1323
 搜索
搜索